Prof. Con Tam, Peter MacCallum Cancer Center
Was sind klinische Studien?
Eine klinische Studie ist ein wichtiger Teil der Gesundheitsforschung. Eine klinische Studie ist eine kontrollierte Methode, um wichtige Fragen zu einer neuen Behandlung, Technologien, Tests oder einer neuen Art der Behandlung zu beantworten. Eine klinische Studie wird Fragen stellen wie:
- Die Sicherheit und Wirksamkeit neuer Medikamente
- Das Hinzufügen neuer Medikamente zu Standardbehandlungen
- Suchen Sie nach neuen Wegen, um Standardbehandlungen durchzuführen
- Vergleichen Sie eine neue Behandlung mit alten, um zu sehen, welche bessere Ergebnisse mit weniger Nebenwirkungen erzielt
Die ausgezeichneten Behandlungen, die derzeit zur Anwendung zugelassen sind, sind das Ergebnis langjähriger Labor- und klinischer Forschung.
Der wichtigste Faktor bei der Durchführung einer klinischen Studie ist die Sicherheit und das Wohlbefinden der teilnehmenden Patienten. Alle klinischen Studien in Australien wurden von verschiedenen Komitees streng geprüft und genehmigt, um sicherzustellen, dass die Studie wissenschaftlich und ethisch einwandfrei ist und alle australischen regulatorischen Anforderungen erfüllt. Diese Überprüfungen müssen abgeschlossen sein, bevor Patienten in eine klinische Studie aufgenommen werden können.
Klinische Studien unterliegen nationalen Ethikrichtlinien und Verhaltenskodizes. Weitere Informationen zu den Anforderungen finden Sie unter Nationale Erklärung zum ethischen Verhalten in der Humanforschung und dem Australischer Kodex für verantwortungsvolles Forschungsverhalten.
Klinische Versuche mit nicht zugelassenen Substanzen und Geräten müssen den Anforderungen der Therapeutic Goods Administration (TGA) und den von der TGA verabschiedeten internationalen Richtlinien entsprechen. Die Therapeutic Goods Administration (TGA) ist eine australische Regierungsbehörde, die alle in Australien verkauften Arzneimittel reguliert. Jedes experimentelle Medikament, das in einer klinischen Studie verwendet wird, muss bei der TGA registriert werden. Für weitere Informationen besuchen Sie tga.gov.au.
Klinische Studien unterliegen der Überprüfung und Prüfung durch pharmazeutische Unternehmen, nationale und internationale Aufsichtsbehörden wie die TGA und die FDA.
Die strenge Art und Weise, wie klinische Studien genehmigt und durchgeführt werden, stellt sicher, dass die Sicherheit und die Rechte der Teilnehmer geschützt sind und dass die gesammelten Daten von hoher Qualität sind.
Prof. Judith Trotman, Concord Hospital
Wie sind klinische Studien konzipiert?
Klinische Studien sind auf wissenschaftliche Weise konzipiert, um fair und sicher für die teilnehmenden Patienten zu sein.
Die Erprobung neuer Medikamente und Behandlungsansätze dauert lange. Bevor Behandlungen an Menschen erprobt werden, haben Wissenschaftler und Ärzte viele Jahre mit Laborforschung verbracht. Es wird ein Plan erstellt, um die neue Behandlung in Phasen zu testen. Die Ergebnisse jeder Studie werden analysiert, bevor sie in die nächste Phase übergehen können.
Es gibt 4 Phasen klinischer Studien:
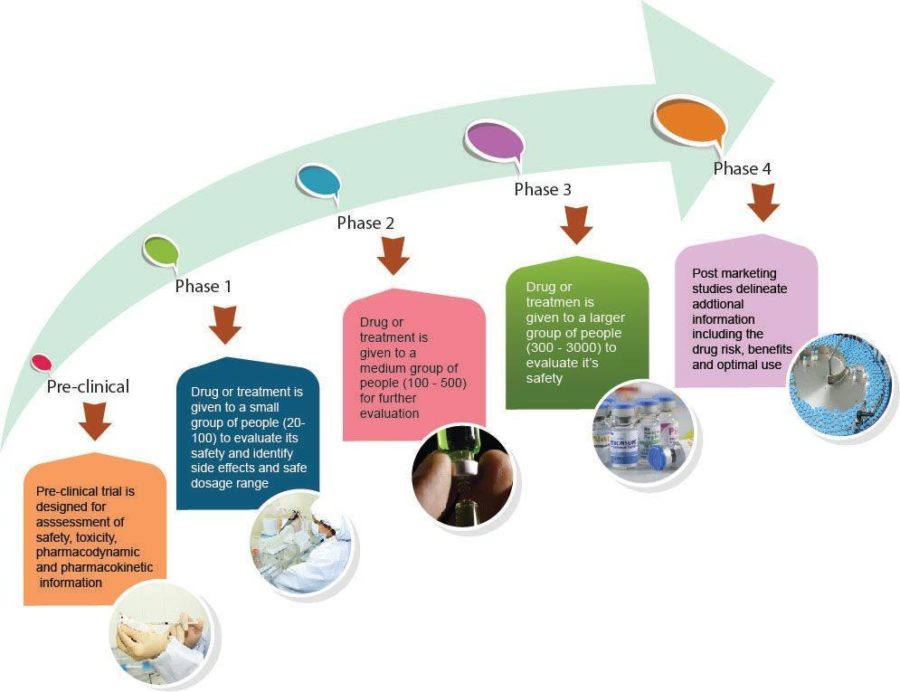
| Zweck | Wie wird es durchgeführt | |
| Phase I | Bewerten Sie das Sicherheitsprofil und die Nebenwirkungen Legen Sie eine sichere Dosis fest, die in späteren Studienphasen weiter untersucht wird | Sehr kleine Teilnehmerzahlen (20-50) Bei Versuchen mit neuen Arzneimitteln erhalten die Teilnehmer in der Regel eine sehr kleine Dosis, und sobald sich diese Dosis als sicher erweist, wird sie für die nächste Gruppe von Teilnehmern erhöht. Oft müssen sich die Teilnehmer zusätzlichen Tests unterziehen, z. B. Bluttests, Herztests. |
| Phase 2 | Betrachten wir weiter das Sicherheitsprofil Genauer untersuchen, wie gut die Dosis des Arzneimittels gegen die Krankheit wirkt | Größere Zahlen als bei einer Phase-1-Studie (100-500) |
| Phase 3 | In dieser Phase wird das neue Medikament oder die neue Behandlung mit einer aktuellen Behandlung verglichen | Zahlreiche Teilnehmer haben sich angemeldet (über 300+) |
| Phase 4 | Sobald das Arzneimittel zur Anwendung zugelassen ist, dienen diese Studien dazu, die Wirksamkeit des zugelassenen Arzneimittels in der Allgemeinbevölkerung zu überwachen | Sehr große Teilnehmerzahlen |
Was bedeutet Randomisierung?
Wenn Studien Behandlungen miteinander vergleichen, handelt es sich häufig um randomisierte Studien. Das heißt, sobald Sie einer Teilnahme an einer Studie zugestimmt haben, ordnet Sie ein Computer nach dem Zufallsprinzip einer der Behandlungsmethoden zu. Die Behandlungen werden oft als „Behandlungsarme“ bezeichnet.
Weder Sie noch Ihr Arzt können wählen, welchem Behandlungsarm Sie zugeteilt werden. Dieser Prozess wird verwendet, um sicherzustellen, dass eine Studie fair ist und dass die Ergebnisse jeder Gruppe wissenschaftlich verglichen werden können.
Was bedeutet Blendung?
Verblindung bezieht sich auf die Verschleierung der Art einer Behandlung, die ein Teilnehmer erhält. In einigen Studien wird verblindet, damit die Teilnehmer nicht wissen, welche Behandlung sie erhalten. Dies wird als Blindversuch bezeichnet. In einer verblindeten klinischen Studie wissen die Teilnehmer nicht, in welchem Arm der Studie sie sich befinden. Das Ziel der Verblindung besteht darin, Verzerrungen bei der Berichterstattung über Nutzen und Nebenwirkungen zu reduzieren.
Was ist ein Placebo?
Ein Placebo ist eine inaktive oder Scheinbehandlung. Es soll aussehen, schmecken oder sich anfühlen wie die getestete Behandlung. Der Unterschied besteht darin, dass es keine Wirkstoffe enthält. Ein Placebo wird verwendet, um sicherzustellen, dass die Ergebnisse auf die tatsächliche Behandlung zurückzuführen sind. Wenn ein Placebo verwendet wird, erfolgt dies zusätzlich zur Standardbehandlung. Sie haben keine Placebo-Behandlung allein. Beispielsweise können Sie die Standardbehandlung und die experimentelle Behandlung erhalten. Sie erhalten möglicherweise die Standardbehandlung und ein Placebo.
Sie werden immer darüber informiert, ob in der Studie, in der Sie sich befinden, Placebos verwendet werden. Sie werden nicht darüber informiert, ob Sie die experimentelle Behandlung oder das Placebo erhalten.
Dr. Michael Dickinson, Peter MacCallum Cancer Center
Was passiert bei einer klinischen Studie?
Klinische Studien werden nach einem voreingestellten Plan oder Protokoll durchgeführt. Das Protokoll legt fest, welche Patienten in die Studie aufgenommen werden können, welche Tests erforderlich sind, welche Behandlung durchgeführt wird und welche Nachsorge erforderlich ist. Sie können mehr darüber lesen, was passieren kann, wenn Sie sich für eine klinische Studie anmelden.
Was bedeutet Einwilligung nach Aufklärung?
Bevor jemand in eine klinische Studie aufgenommen werden kann, muss er eine Einverständniserklärung unterschreiben. Dieser Prozess ist sehr wichtig. Die Teilnahme ist vollkommen freiwillig. Niemand sollte gezwungen oder unter Druck gesetzt werden, an einer klinischen Studie teilzunehmen. Die Ärzte und das Team der klinischen Studien erklären Ihnen die klinische Studie im Detail. Sie stellen sicher, dass Sie über ein schriftliches Informationsblatt verfügen. Sie haben ausreichend Zeit, die Informationen zu lesen und zu überlegen, ob Sie teilnehmen möchten. Es ist wichtig, dass Sie genau verstehen, worum es geht, einschließlich der Vorteile und Risiken einer Teilnahme. Einige klinische Studien erfordern möglicherweise zusätzliche Termine und Tests. All dies wird erklärt und steht im Informationsblatt. Sie können sich Zeit nehmen, dies mit Ihrer Familie, Freunden oder sogar Ihrem Hausarzt zu besprechen. Sie müssen nicht an der klinischen Studie teilnehmen. Es ist allein Ihre Entscheidung und Ihre Ärzte verstehen, wenn Sie nicht teilnehmen möchten. Wenn Sie sich entscheiden, nicht teilzunehmen, erhalten Sie die aktuelle Behandlung, die für Sie verfügbar ist.
Sobald Sie sich für die Teilnahme entschieden haben, müssen Sie eine Einverständniserklärung unterschreiben. Dies geschieht mit Ihrem Arzt
Was bedeutet die Förderfähigkeit einer klinischen Studie?
Sobald Sie der Teilnahme zugestimmt und die Einverständniserklärung unterschrieben haben, beginnen Sie mit einem Prozess, um sicherzustellen, dass die Studie für Sie geeignet ist. Dies wird als Erfüllung der Eignungskriterien bezeichnet. Das sind Voraussetzungen, die erfüllt werden müssen, damit sich die teilnehmenden Personen möglichst ähnlich sind. Wenn die Studie nicht geeignet ist, weil Sie die Eignung nicht erfüllen, wird Ihr Arzt andere Optionen mit Ihnen besprechen.
Behandlung
Sobald alle Eignungskriterien bewertet wurden und die Studie für Sie geeignet ist, wird Ihnen eine Behandlungsgruppe zugewiesen. Während der Behandlungsdauer besuchen Sie das Krankenhaus regelmäßig zur Behandlung und Untersuchung. Möglicherweise müssen Sie zusätzliche Besuche machen und zusätzliche Tests durchführen lassen. Möglicherweise müssen Sie auch Fragen dazu beantworten, wie Sie sich fühlen. Die Anweisungen werden von Ihrem Arzt und dem Pflegepersonal erklärt. Die Informationen finden Sie auch in dem Informationsblatt, das Sie erhalten haben, bevor Sie der Studie zugestimmt haben. Es ist wichtig, dass Sie alle Anweisungen befolgen und sich bei Fragen an Ihren Arzt oder das medizinische Fachpersonal wenden.
Nachsorge
Wenn Sie Ihre Behandlung abgeschlossen haben, treten Sie in eine Phase ein, die als Nachsorge bekannt ist. Sie werden von Ihrem Arzt und dem medizinischen Fachpersonal untersucht und müssen möglicherweise zusätzliche Tests durchführen lassen. Zum Beispiel Blutuntersuchungen, Herztests oder Fragebögen.
Abbruch einer klinischen Studie
Wenn Sie sich entscheiden, nicht mehr an der klinischen Studie teilnehmen zu wollen, können Sie jederzeit ohne Angabe von Gründen aussteigen. Dafür werden Sie nicht bestraft. Wenn Sie Ihre Einwilligung widerrufen, erhalten Sie die Standardbehandlung, die derzeit die beste Option für Sie ist.
Wie finde ich eine klinische Studie?
Ihr Arzt wird über klinische Studien Bescheid wissen, die für Sie geeignet sind. Wenn Ihr Arzt nicht mit Ihnen über klinische Studien spricht und Sie an einer Teilnahme interessiert sind, können Sie Ihren Arzt fragen, ob etwas verfügbar ist. Sie können auch fragen, ob es Studien in anderen Krankenhäusern gibt, zu denen Sie bereit sind zu reisen. Ihr Arzt wird nicht beleidigt sein, wenn Sie danach fragen.
Es gibt mehrere Orte, an denen Sie sich über klinische Studien informieren können;
Das Ärzteteam
Der erste Schritt besteht darin, mit Ihrem Arzt darüber zu sprechen, welche Optionen Ihnen zur Verfügung stehen. Sie müssen fragen, ob es eine klinische Studie gibt, die für Sie geeignet ist. Ihr Arzt kennt Sie und Ihre Krankengeschichte am besten. Sie wissen normalerweise, ob es in Ihrem Krankenhaus, Ihrer Gegend und auf der Autobahn etwas Passendes gibt. Wenn sie nicht wissen, welche klinischen Studien verfügbar sind, können sie andere Ärzte in Australien fragen, ob sie von einer Studie wissen.
Zweite Meinung
Eine weitere Möglichkeit besteht darin, eine zweite Meinung bei einem anderen Arzt einzuholen. Viele Patienten fragen nach einer zweiten Meinung. Die meisten Ärzte fühlen sich auch damit wohl, also machen Sie sich keine Sorgen, sie zu beleidigen. Die meisten Ärzte verstehen, dass Ihr Leben wichtig ist und Sie sich sicher fühlen müssen, dass Sie alle richtigen Fragen gestellt haben und Ihre Möglichkeiten kennen.
ClinTrial-Referenz
Dies ist eine australische Website, die entwickelt wurde, um die Teilnahme an der Forschung zu klinischen Studien zu erhöhen. Es steht allen Patienten, allen Studien und allen Ärzten zur Verfügung. Das Ziel ist:
- Forschungsnetzwerke stärken
- Verbinden Sie sich mit Empfehlungen
- Studienteilnahme als Behandlungsoption einbetten
- Einen Unterschied in der klinischen Forschungstätigkeit machen
- Es gibt auch eine App-Version
ClinicalTrials.gov
ClinicalTrials.gov ist eine Datenbank mit privat und öffentlich finanzierten klinischen Studien, die weltweit durchgeführt werden. Patienten können ihren Lymphom-Subtyp, die Studie (falls bekannt) und ihr Land eingeben und es wird angezeigt, welche Studien derzeit verfügbar sind.
Australasian Leukemia & Lymphoma Group (ALLG)
ALLG & klinische Studien
Kate Halford, ALLG
Die Australasian Leukemia & Lymphoma Group (ALLG) ist Australiens und Neuseelands einzige gemeinnützige Forschungsgruppe für klinische Studien zu Blutkrebs. Angetrieben von ihrem Zweck „Bessere Behandlungen … Besseres Leben“ setzt sich die ALLG dafür ein, die Behandlung, das Leben und die Überlebensraten von Patienten mit Blutkrebs durch die Durchführung klinischer Studien zu verbessern. Durch die Zusammenarbeit mit Blutkrebsspezialisten auf lokaler und internationaler Ebene ist ihre Wirkung tiefgreifend. Die Mitglieder sind Hämatologen und Forscher aus ganz Australien, die mit Kollegen auf der ganzen Welt zusammenarbeiten.
Blutkrebsforschung Westaustralien
A/Prof. Chan Cheah, Sir Charles Gairdner Hospital, Hollywood Private Hospital & Blood Cancer WA
Das Blood Cancer Research Centre of Western Australia, spezialisiert auf die Erforschung von Leukämie, Lymphom und Myelom. Ihr Zweck ist es, WA-Patienten mit Blutkrebs schneller Zugang zu neuen und potenziell lebensrettenden Behandlungen zu verschaffen.
Klinische Studien sind der beste Weg, dies zu erreichen, und werden an drei unserer Standorte in Perth, dem Sir Charles Gardiner Hospital, Linear Clinical Research und dem Hollywood Private Hospital, durchgeführt.
Krebsstudien in Australien
Diese Website enthält und stellt Informationen bereit, die die neuesten klinischen Studien in der Krebsbehandlung anzeigen, einschließlich Studien, für die derzeit neue Teilnehmer rekrutiert werden.
Peter MacCallum Krebszentrum
Das Peter MacCallum Cancer Center ist ein erstklassiges Krebszentrum. Sie sind Australiens größtes Krebsforschungszentrum mit mehr als 750 Mitarbeitern im Labor und in der klinischen Forschung. Weitere Informationen zu ihren klinischen Studien und Ihrer Eignung finden Sie auf deren Website.
Australisch-neuseeländisches Register für klinische Studien
Das Australian New Zealand Clinical Trial Registry (ANZCTR) ist ein Online-Register klinischer Studien, die in Australien, Neuseeland und anderswo durchgeführt werden. Besuchen Sie die Website, um zu sehen, welche Studien derzeit rekrutieren.
Lymphom-Koalition
Die Lymphoma Coalition, ein weltweites Netzwerk von Lymphompatientengruppen, wurde 2002 gegründet und 2010 als gemeinnützige Organisation eingetragen. Ihr ausdrücklicher Zweck ist es, weltweit gleiche Informationsbedingungen zu schaffen und eine Gemeinschaft von Lymphompatientenorganisationen zu fördern sich gegenseitig in ihren Bemühungen zu unterstützen, Patienten mit Lymphomen zu helfen, die erforderliche Pflege und Unterstützung zu erhalten.
Es wurde die Notwendigkeit einer zentralen Anlaufstelle für konsistente und zuverlässige aktuelle Informationen sowie die Notwendigkeit für Lymphom-Patientenorganisationen erkannt, Ressourcen, bewährte Verfahren sowie Richtlinien und Verfahren auszutauschen. Vor diesem Hintergrund haben vier Lymphom-Organisationen die LC ins Leben gerufen. Heute gibt es 83 Mitgliedsorganisationen aus 52 Ländern.
Wenn Sie eine Studie finden, an der Sie teilnehmen möchten, fragen Sie Ihren Arzt, ob Sie die Zulassungskriterien erfüllen und, falls ja, ob er Ihre Teilnahme koordinieren oder Sie mit dem Forschungsteam in Kontakt bringen könnte.
Welche Vorteile hat die Teilnahme an einer klinischen Studie?
Der Hauptvorteil der Teilnahme an einer klinischen Studie besteht darin, dass Menschen neue Behandlungen erhalten können, die noch nicht für die klinische Praxis verfügbar sind, oder bestehende Behandlungen, die für ihre Umstände nicht verfügbar sind. Wenn beispielsweise eine Person die Standardbehandlung für ihren speziellen Lymphomtyp erhalten hat und nicht das gewünschte Ansprechen erzielt hat, kann eine klinische Studie eine gute Option sein. Prüfbehandlungen stehen Personen außerhalb einer klinischen Studie nicht zur Verfügung. Damit eine Behandlung Menschen in Australien verabreicht werden kann, muss sie gründlich untersucht und getestet und von der Therapeutic Goods Administration (TGA) genehmigt worden sein. Die TGA ist die Regierungsbehörde, die alle therapeutischen Produkte bewertet und überwacht, um sicherzustellen, dass sie einem akzeptablen Standard entsprechen, bevor sie der australischen Gemeinschaft zur Verfügung gestellt werden.
Welche Risiken birgt die Teilnahme an einer klinischen Studie?
Sie sollten sich der Risiken bewusst sein, bevor Sie an einer klinischen Studie teilnehmen. Sie beinhalten:
- Die Behandlung kann toxisch sein, sodass bei Ihnen schwere oder unbekannte Nebenwirkungen auftreten können
- Die Behandlung kann sich als weniger wirksam erweisen als Standardtherapien und wenig oder gar keinen Nutzen bringen
- Sie befinden sich möglicherweise in der Kontrollgruppe der klinischen Studie und erhalten als solche möglicherweise eine Standard-Lymphomtherapie und nicht die experimentelle Behandlung
Fragen an Ihren Arzt
- Was ist der Zweck dieser klinischen Studie?
- Wie lange wird das Studium dauern?
- Werde ich in einem Studium besser aufgehoben sein?
- Wie könnte sich die Studie auf mein tägliches Leben auswirken?
- Fallen Kosten für die Teilnahme an der Studie an?
- Ist jeder mit meiner Krankheit für diese Studie geeignet?
- Wenn ich an einer Studie teilnehme, bekomme ich nicht die beste verfügbare Behandlung?
Klinische Studien verstehen – Videos zu Lymphoma Australia
Prof. Judith Trotman, Concord Hospital
Dr. Michael Dickinson, Peter MacCallum Cancer Center
Prof. Con Tam, Peter MacCallum Cancer Center
Dr. Eliza Hawkes, Krebsforschungszentrum Austin Health & ONJ
Dr. Eliza Hawkes, Krebsforschungszentrum Austin Health & ONJ
Kate Halford, ALLG
A/Prof. Chan Cheah, Sir Charles Gairdner Hospital, Hollywood Private Hospital & Blood Cancer WA
Klinische Studien zur Rekrutierung offen
Klinische Studie: Tislelizumab für Teilnehmer mit rezidiviertem oder refraktärem klassischem Hodgkin-Lymphom (TIRHOL) [Stand: Juli 2021]
Informationsquellen
Das National Statement on Ethical Conduct in Human Research (2007) (National Statement (2007)) besteht aus einer Reihe von Richtlinien, die in Übereinstimmung mit dem National Health and Medical Research Council Act 1992 erstellt wurden.
Der australische Kodex für verantwortungsvolles Forschungsverhalten, 2018
Kann J Surg. 2010 Oktober; 53 (5): 345-348.
Verblindung: Wer, was, wann, warum, wie?
Paul J. Karanicolas, MD, PhD,*† Forough Farrokhyar, MPhil, PhD,†‡ und Mohit Bhandari, MD, MSc

