An allogeensete tüvirakkude siirdamine on intensiivne ravi, mille käigus teile siirdatakse doonori (kellegi teise) tüvirakud. See erineb sellest, kui patsient saab oma rakud tagasi, mida nimetatakse an autoloogsete tüvirakkude siirdamine. Seda arutatakse teisel lehel.
Ülevaade allogeensetest tüvirakkude siirdamisest?
Dr Amit Khot, hematoloog ja luuüdi siirdamise arst
Peter MacCallumi vähikeskus ja Melbourne'i kuninglik haigla
Allogeense tüvirakkude siirdamisel kasutatakse teie enda tüvirakkude asendamiseks doonorilt (kelleltki teiselt) kogutud tüvirakke. Seda tehakse selleks, et ravida refraktaarset (ravile mitte alluvat) või ägenevat lümfoomi (lümfoom, mis taastub pidevalt. Enamik lümfoomi põdevaid inimesi ei vaja tüvirakkude siirdamist. Lümfoomi puhul on allogeensed (doonor-) siirdamised palju harvemad kui autoloogsed ( ise) siirdamine.
Lümfoom on lümfotsüütide vähk. Lümfotsüüdid on teatud tüüpi valged verelibled, mis arenevad tüvirakkudest. Eesmärk keemiaravi eesmärk on hävitada lümfoomirakud ja kõik tüvirakud, mis võivad kasvada lümfoomiks. Kui halvad rakud on likvideeritud, võivad uued rakud tagasi kasvada, mis loodetavasti ei ole vähkkasvajad.
Relapseerunud või refraktaarse lümfoomiga inimestel see ei toimi – vaatamata ravile kasvab lümfoomi juurde. Seetõttu võib tüvirakkude hävitamine väga suurte keemiaravi annustega ja seejärel selle inimese tüvirakkude asendamine kellegi teise omadega kaasa tuua uue immuunsüsteemi, kus doonori tüvirakud võtavad üle rolli toota vererakke, mis ei muutu lümfoomiks.
Tüvirakkude siirdamise eesmärk
On mitmeid põhjuseid, miks lümfoomiga patsiendid võivad vajada tüvirakkude siirdamist, sealhulgas:
- Lümfoomiga patsientide raviks, kellel on remissioon, kuid neil on suur risk lümfoomi taastumiseks
- Lümfoom on taastunud pärast esialgset standardset esmavaliku ravi, seega kasutatakse intensiivsemat (tugevamat) kemoteraapiat, et saada tagasi remissioon (haigus pole tuvastatav).
- Lümfoom ei allu (ei ole täielikult reageerinud) standardsele esmavaliku ravile eesmärgiga saavutada remissioon
Allogeensete tüvirakkude siirdamine võib pakkuda kahte funktsiooni
- Keemiaravi väga suured annused kõrvaldavad lümfoomi ja uued doonorrakud võimaldavad immuunsüsteemil taastuda, vähendades immuunsüsteemi tegevusetuse aega. Uued doonorrakud võtavad üle immuunsüsteemi funktsiooni ja tervete vererakkude, näiteks lümfotsüütide, tootmise. Doonori tüvirakud asendavad patsiendi düsfunktsionaalseid tüvirakke.
- Transplantaadi ja lümfoomi efekt. See on siis, kui doonori tüvirakud (nn transplantaat) tunnevad ära kõik allesjäänud lümfoomirakud ja ründavad neid, hävitades lümfoomi. See on positiivne mõju, kui doonori tüvirakud aitavad lümfoomi ravida. Oluline on märkida, et see transplantaat versus lümfoomi efekt ei juhtu alati nii. Lümfoom võib olla resistentne doonori tüvirakkude suhtes või retsipiendi keha (nimetatakse peremeesorganismiks) võib võidelda doonorrakkude vastu (nn transplantaat), mille tulemuseks on transplantaat versus peremeeshaigus (allogeense siirdamise tüsistus).
Allogeense tüvirakkude siirdamise protsessil on viis etappi
Dr Amit Khot, hematoloog ja luuüdi siirdamise arst
Peter MacCallumi vähikeskus ja Melbourne'i kuninglik haigla
- Ettevalmistus: see hõlmab vereanalüüse, et määrata kindlaks, millist tüüpi rakke vajate. Mõnikord peavad inimesed saama päästvat keemiaravi, et enne siirdamist lümfoomi minimeerida.
- Tüvirakkude kogumine: see on tüvirakkude kogumise protsess, kuna allogeenne siirdamine pärineb doonorilt, meditsiinimeeskond peab leidma siirdamiseks sobiva.
- Konditsioneeriv ravi: see on keemiaravi, sihtravi ja immunoteraapia, mida manustatakse väga suurtes annustes, et kõrvaldada kogu lümfoom.
- Tüvirakkude refusioon: pärast suurte annuste manustamist manustatakse tüvirakud, mis on eelnevalt doonorilt kogutud.
- Siirdamine: see on protsess, mille käigus doonori tüvirakud settivad kehasse ja võtavad üle immuunsüsteemi toimimise.
Ettevalmistus raviks
Tüvirakkude siirdamiseks on vaja palju ettevalmistusi. Iga siirdamine on erinev ja siirdamismeeskond peaks kõik patsiendi jaoks korraldama. Mõned oodatavad ettevalmistused võivad hõlmata järgmist:
Keskjoone sisestamine
Kui patsiendil ei ole veel keskjoont, sisestatakse see enne siirdamist. Keskliin võib olla kas PICC (perifeerselt sisestatud keskkateeter). See võib olla CVL (keskveeniliin). Arst otsustab, milline keskjoon on patsiendile parim.
Keskjoon annab võimaluse saada korraga palju erinevaid ravimeid. Üldjuhul vajavad patsiendid siirdamise ajal palju erinevaid ravimeid ja vereanalüüse ning keskliin aitab õdedel patsiendiga paremini toime tulla.
Keemiaravi
Suure annusega keemiaravi manustatakse alati siirdamisprotsessi osana. Suurte annustega keemiaravi nimetatakse konditsioneeriv teraapia. Väljaspool suurte annustega keemiaravi vajavad mõned patsiendid päästvat keemiaravi. Päästeteraapia on siis, kui lümfoom on agressiivne ja seda tuleb vähendada enne, kui ülejäänud siirdamisprotsess saab edasi minna. Nimi päästmine tuleneb katsest päästa keha lümfoomist.
Ümberpaigutamine raviks
Allogeensete tüvirakkude siirdamist saavad läbi viia ainult teatud Austraalia haiglad. Seetõttu võib tekkida vajadus kolida oma kodust haiglale lähemal asuvasse piirkonda. Enamikus siirdamishaiglates on patsiendi eluase, kus patsient ja hooldaja saavad elada. Öelge oma ravikeskuse sotsiaaltöötajaga, et saada teavet majutusvõimaluste kohta.
Viljakuse säilitamine
Tüvirakkude siirdamine mõjutab patsiendi võimet saada lapsi. On oluline, et arutataks võimalikke võimalusi viljakuse säilitamiseks.
Praktilised nõuanded
Tüvirakkude siirdamine hõlmab tavaliselt pikka haiglas viibimist. Võib olla kasulik pakkida mõni järgmistest asjadest:
- Mitu paari pehmeid mugavaid riideid või pidžaamat ja ohtralt aluspesu.
- Hambahari (pehme), hambapasta, seep, õrn niisutaja, õrn deodorant
- Teie enda padi (enne haiglasse minekut peske padjapüür ja isiklikud tekid/vaibad kuumalt – bakterite vähendamiseks peske neid kuumalt, kuna teie immuunsüsteem on väga haavatav).
- Sussid või mugavad jalanõud ja ohtralt sokipaari
- Isiklikud esemed teie haiglatoa ilmestamiseks (foto teie lähedastest)
- Meelelahutustarbed, nagu raamatud, ajakirjad, ristsõnad, iPad/sülearvuti/tahvelarvuti. Haiglas võib olla väga igav, kui sul pole midagi teha.
- Kalender kuupäevade jälgimiseks, pikad haiglaravid võivad kõik päevad koos hägustada.
HLA ja kudede tüpiseerimine
Allogeense (doonor) tüvirakkude siirdamisel korraldab siirdamise koordinaator sobiva tüvirakudoonori otsingu. Allogeensete tüvirakkude siirdamine on kõige tõenäolisemalt edukas, kui doonori rakud vastavad täpselt patsiendile. Selle kontrollimiseks tehakse patsiendile vereanalüüs nn kudede tüpiseerimine mis vaatleb erinevaid valke rakkude pinnal, mida nimetatakse inimese leukotsüütide antigeenid (HLA).
Iga inimese rakud toodavad HLA valke, et aidata immuunsüsteemil ära tunda kehasse kuuluvaid rakke ja mittekuuluvaid rakke.
HLA-d on palju erinevaid ja meditsiinimeeskond püüab leida doonorit, kelle HLA-tüübid vastavad võimalikult täpselt omale.
Võimaluse korral püüavad nad ka veenduda, et patsient ja doonor on kokku puutunud samade viirustega, kuigi see on vähem oluline kui HLA-vastavus.
Vendadel või õdedel on kõige tõenäolisemalt patsiendiga sarnased HLA valgud. Umbes igal kolmandal inimesel on vend või õde, kes sobib hästi. Kui patsiendil ei ole vendi või õdesid või kui nad ei sobi hästi, otsib meditsiinimeeskond vabatahtlikku doonorit, kelle HLA tüüp vastab võimalikult täpselt patsientidele. Seda nimetatakse sobitatud sõltumatuks doonoriks (MUD) ja miljonid vabatahtlikud on registreeritud riiklikes ja ülemaailmsetes tüvirakkude registrites.
Kui patsiendi jaoks sobivat mitteseotud doonorit (MUD) ei leita, võib olla võimalik kasutada muid tüvirakkude allikaid. Need sisaldavad:
- Sugulane, kelle HLA tüüpi pool vastab teie omale: seda nimetatakse haploidentiliseks doonoriks
- Nabaväädiveri sõltumatult doonorilt: nabaväädiveri ei pea olema nii täpselt vastavuses teie HLA tüübiga kui muud tüvirakkude allikad. Seda kasutatakse tõenäolisemalt lastele kui täiskasvanutele, kuna see sisaldab vähem tüvirakke kui muud allikad. Saadaval on salvestatud nabaväädivere registrid.
Tüvirakkude kogumine
Doonor saab tüvirakke annetada kahel viisil.
- Perifeerse vere tüvirakkude kogumine
- Luuüdi vere tüvirakkude annetamine
Perifeerse vere tüvirakkude annetamine
Perifeersed tüvirakud kogutakse perifeersest vereringest. Perifeersete tüvirakkude kogumiseni süstitakse enamikule inimestest kasvufaktorit. Kasvufaktorid stimuleerivad tüvirakkude tootmist. See aitab tüvirakkudel liikuda luuüdist vereringesse ja kogumiseks valmis.
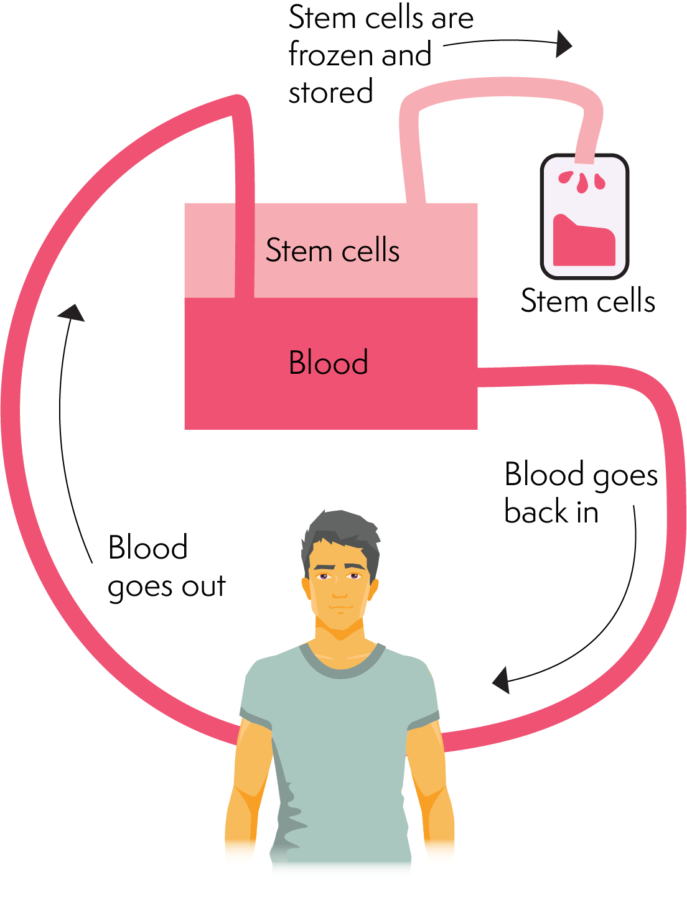
Kogumine toimub tüvirakkude eraldamise teel ülejäänud verest ja protsessis kasutatakse afereesimasinat. Afereesimasin suudab eraldada vere erinevaid komponente ja tüvirakke. Kui veri on läbinud rakkude kogumise faasi, liigub see tagasi kehasse. See protsess võtab mitu tundi (umbes 2–4 tundi). Doonor võib pärast protseduuri koju minna, kuid kui rakke ei kogutud piisavalt, võib ta järgmisel päeval tagasi pöörduda.
Aferees on vähem invasiivne kui luuüdi kogumine ja osaliselt seetõttu on see tüvirakkude kogumise eelistatud meetod.
Allogeense (doonori) siirdamise korral läbib doonor retsipiendi jaoks afereesi ja see kogumine toimub võimalikult lähedal siirdamispäevale. Kuna need tüvirakud toimetatakse siirdamise päeval retsipiendile värskelt.
Luuüdi vere tüvirakkude annetamine
Vähem levinud lähenemine tüvirakkude kogumisele on luuüdi kogumine. See on koht, kus tüvirakud eemaldatakse luuüdist üldnarkoosis. Arstid sisestavad nõela vaagnapiirkonna luusse, mida nimetatakse niudeharjaks. Luuüdi eemaldatakse vaagnast läbi nõela ja see luuüdi seejärel filtreeritakse ja säilitatakse kuni siirdamise päevani.
Nööri veri annetamine toimub avalikust nabaväädipangast, kuhu on annetatud ja säilitatud pärast lapse sündi nabanööri ja platsentasse jäänud vere tüvirakke.
Kuidas aferees töötab
Tüvirakkude või luuüdi töötlemine/säilitamine
Allogeense (doonori) siirdamise jaoks kogutud tüvirakud kogutakse vahetult enne kasutamist ja neid ei säilitata kaua.
Autoloogseks (enese)siirdamiseks kogutud tüvirakud säilitatakse üldiselt ja säilitatakse kuni kasutusvalmistamiseni sügavkülmas.
Konditsioneerimine
Siirdatavatele patsientidele antakse esmalt ravi, mida nimetatakse konditsioneerimisrežiimiks. See on suurte annustega ravi, mida manustatakse päevadel enne tüvirakkude infundeerimist. Konditsioneeriv ravi võib hõlmata keemiaravi ja mõnikord kiiritusravi. Konditsioneeriva ravi kaks eesmärki on:
- Et tappa võimalikult palju lümfoomi
- Tüvirakkude populatsiooni vähendamine
Konditsioneerimisrežiimides saab kasutada palju erinevaid keemiaravi, kiiritusravi ja immunoteraapia kombinatsioone. Konditsioneerivat ravi on erineva intensiivsusega, need on:
- Täieliku intensiivsusega müeloablatiivne konditsioneerimine
- Mittemüeloablatiivne konditsioneerimine
- Vähendatud intensiivsusega konditsioneerimine
Kõigi raviskeemide puhul on ravi intensiivne ja selle tulemusena sureb koos lümfoomiga palju terveid rakke. Raviskeemi valik sõltub lümfoomi tüübist, ravi ajaloost ja muudest individuaalsetest teguritest, nagu vanus, üldine tervislik seisund ja sobivus. Ravimeeskond arutab patsiendiga, milline ravirežiim on patsiendile sobiv.
Allogeense siirdamise korral võib patsiente haiglasse viia juba 14 päeva enne siirdamist. Iga patsiendi juhtum on erinev ja teie arst annab teile teada, millal teid vastu võetakse. Patsiendid jäävad haiglasse 3–6 nädalat pärast siirdamist. See on suunis; iga siirdamine on erinev ja mõned inimesed vajavad rohkem arstiabi kauem kui 6 nädalat.
Kui teile tehakse allogeensete tüvirakkude siirdamine, kasutades mitteseotud või olulise mittevastava doonori tüvirakke, võite vajada suurema intensiivsusega konditsioneerimisravi.
Kui teile tehakse allogeenset siirdamist, kasutades nabaväädivere või pooleldi sugulase tüvirakke, võib teil olla erinev konditsioneerimisravi.
Üksikasjalikku teavet konditsioneerimisrežiimide kohta leiate veebisaidilt Eviqi veebisait.
Tüvirakkude refusioon
Pärast intensiivse konditsioneeriva keemiaravi lõppu infundeeritakse tüvirakud uuesti. Need tüvirakud hakkavad aeglaselt tootma uusi terveid vererakke. Lõpuks toodavad nad piisavalt terveid rakke, et kogu luuüdi uuesti asustada, täiendades kõiki vere- ja immuunrakke.
Tüvirakkude uuesti infundeerimine on lihtne protseduur. See sarnaneb vereülekandega. Rakud antakse joone kaudu keskjoonele. Päeva, mil tüvirakud uuesti infundeeritakse, nimetatakse nullpäevaks.
Mis tahes meditsiinilise protseduuriga kaasneb tüvirakkude infusioonile reageerimise oht. Enamiku inimeste jaoks puudub reaktsioon, kuid teised võivad kogeda:
- Haige või haige tunne
- Halb maitse või põletustunne suus
- Kõrge vererõhk
- Allergiline reaktsioon
- Infektsioon
Allogeensete tüvirakkude siirdamisel, kuna need annetatud rakud kinnituvad (või siirduvad) retsipiendis (patsiendis). Nad hakkavad toimima immuunsüsteemi osana ja võivad rünnata lümfoomirakke. Seda nimetatakse transplantaat versus lümfoomi efekt.
Mõnel juhul ründavad doonorrakud pärast allogeenset siirdamist ka patsiendi terveid rakke. Seda nimetatakse transplantaat-peremehe vastu haigus (GVHD).
Teie tüvirakkude siirdamine
Siirdamine on siis, kui uued tüvirakud hakkavad järk-järgult üle võtma esmaste tüvirakkudena. See juhtub tavaliselt umbes 2–3 nädalat pärast tüvirakkude infusiooni, kuid võib võtta kauem aega, eriti kui uued tüvirakud on pärit nabaväädiverest.
Uute tüvirakkude siirdamise ajal on teil väga suur oht nakatuda. Inimesed peavad üldjuhul jääma selleks ajaks haiglasse, sest nad võivad haigestuda ja peavad saama kohe ravi.
Kui ootate oma verepildi paranemist, võib teil olla mõni järgmistest ravimeetoditest, et teie taastumist toetada:
- Vereülekanne – punaste vereliblede madala arvu (aneemia) korral
- Trombotsüütide ülekanded – madala trombotsüütide taseme korral (trombotsütopeenia)
- Antibiootikumid – bakteriaalsete infektsioonide korral
- Viirusevastased ravimid - viirusnakkuste raviks
- Seenevastased ravimid - seeninfektsioonide raviks
Siirdamise sündroom
Mõnel inimesel tekivad pärast uute tüvirakkude saamist 2–3 nädalat hiljem, tavaliselt rakkude siirdamise ajal, järgmised sümptomid:
- Palavik: kõrge temperatuur 38 kraadi või rohkem
- Punane lööve
- Kõhulahtisus
- Vedelikupeetus
Seda nimetatakse siirdamise sündroomiks. See on tavalisem pärast enese (autoloogsete) tüvirakkude siirdamist kui doonori (allogeensete) tüvirakkude siirdamist.
See on siirdamise tavaline kõrvalnäht ja seda ravitakse steroididega. Neid sümptomeid võivad põhjustada ka muud tegurid, sealhulgas keemiaravi, ja need ei pruugi olla siirdamise sündroomi tunnuseks.
Mõned levinumad haiglaprotokollid siirdamise ajal on järgmised:
- Tavaliselt viibite oma viibimise ajal haiglatoas üksi
- Haigla tuba koristatakse regulaarselt ning linu ja padjapüüre vahetatakse iga päev
- Teie toas ei tohi olla elusaid taimi ega lilli
- Haigla töötajad ja külastajad peavad enne teie tuppa sisenemist käsi pesema
- Mõnikord võivad külastajad ja haigla töötajad teid külastades kanda kindaid, hommikumantleid või põllesid ja näomaske
Inimesed ei tohiks teid külastada, kui neil on halb olla - Alla teatud vanuses lapsi ei pruugita üldse külastada – kuigi mõned haiglad lubavad seda, kui lapsed on terved
Kui teie verepildid on taastunud ja patsient on piisavalt terve, võib ta koju minna. Pärast seda aega jälgib meditsiinimeeskond neid hoolikalt.
Tüvirakkude siirdamise tüsistused
Siiriku vastu peremeeshaigus (GvHD)
Siiriku vastu peremeeshaigus (GvHD) on allogeense tüvirakkude siirdamise tavaline tüsistus. See juhtub siis, kui:
- Doonor-T-rakud (nimetatakse ka "transplantaadiks") tunnevad ära antigeenid, mis asuvad teistel retsipiendi keha rakkudel (nimetatakse "peremeheks") kui võõrkehad.
- Pärast nende antigeenide äratundmist ründavad doonor-T-rakud oma uue peremehe rakke.
See efekt võib olla kasulik, kui uued doonori T-rakud ründavad allesjäänud lümfoomirakke (nimetatakse siiriku versus lümfoomi efektiks). Kahjuks võivad doonor-T-rakud rünnata ka terveid kudesid. See võib põhjustada tõsiseid kõrvaltoimeid.
Enamasti põhjustab GvHD kergeid kuni mõõdukaid sümptomeid, kuid mõnikord võib see olla tõsine ja isegi eluohtlik. Enne ja pärast siirdamist antakse patsientidele ravi, et vähendada GvHD tekke riski. Siirdamismeeskond jälgib patsienti hoolikalt GvHD nähtude suhtes, et nad saaksid seda võimalikult varakult ravida, kui see areneb.
GvHD klassifitseeritakse olenevalt tunnustest ja sümptomitest kui "äge" või "krooniline".
Nakkusoht
Pärast tüvirakkude siirdamist on keemiaravi suured annused eemaldanud palju valgeid vereliblesid, sealhulgas valgeid vereliblesid, mida nimetatakse neutrofiilideks. Madalat neutrofiilide taset nimetatakse neutropeeniaks. Pikaajaline neutropeenia seab kellegi väga suure infektsiooni tekkeriski. Infektsioone saab ravida, kuid kui neid ei tuvastata varakult ja kohe ei ravita, võivad need olla eluohtlikud.
Haiglas olles, kohe pärast tüvirakkude siirdamist, rakendab ravimeeskond ettevaatusabinõusid, et vältida infektsioonide teket, samuti jälgib hoolikalt nakkusnähtusid. Kuigi infektsiooni nakatumise riski vähendamiseks võetakse palju ettevaatusabinõusid, saavad enamik patsiente, kellel on allogeensete tüvirakkude siirdamine, infektsiooni.
Esimestel nädalatel pärast siirdamist on patsientidel kõige suurem risk bakteriaalse infektsiooni tekkeks. Selliste infektsioonide hulka kuuluvad vereringeinfektsioonid, kopsupõletik, seedesüsteemi infektsioonid või nahainfektsioonid.
Järgmise paari kuu jooksul on patsientidel kõige suurem risk viirusnakkuste tekkeks ja need võivad olla viirused, mis enne siirdamist kehas seisid ja võivad nõrgenenud immuunsüsteemi korral ägeneda. Need ei põhjusta alati sümptomeid. Pärast siirdamist tehakse regulaarseid vereanalüüse, et tagada tsütomegaloviiruse (CMV) nimelise viirusnakkuse ägenemine varakult. Kui vereanalüüs näitab CMV esinemist – isegi kui ilma sümptomiteta – saab patsient ravi viirusevastaste ravimitega. Vaja võib olla rohkem kui üks ravikuur ja see ravi võib pikendada haiglas viibimist.
Verepildid hakkavad tõusma 2–4 nädalat pärast allogeensete tüvirakkude siirdamist. Immuunsüsteemi täielikuks taastumiseks võib aga kuluda mitu kuud või mõnikord isegi aastaid.
Haiglast välja kirjutades peaks meditsiinimeeskond andma nõu, millistele infektsiooninähtudele tähelepanu pöörata ja kelle poole pöörduda, kui esineb võimalik infektsioon või midagi muud, mis võib patsiendile muret tekitada.
Väga suurte annustega keemiaravi kõrvaltoimed
Patsiendid kogevad suure annusega vähivastasest ravist tõenäoliselt kõrvaltoimeid. Järgmised kõrvaltoimed võivad olla tavalised ja lisateavet leiate kõrvaltoimeid lõik
- Suu mukosiit (suuvalu)
- Aneemia (madal punaste vereliblede arv)
- Trombotsütopeenia (madal trombotsüütide arv)
- Iiveldus ja oksendamine
- Seedetrakti probleemid (kõhulahtisus või kõhukinnisus)
Siiriku rike
Siirdamise ebaõnnestumine tekib siis, kui siirdatud tüvirakud ei suuda luuüdis settida ega toota uusi vererakke. See tähendab, et verepildid ei taastu või hakkavad taastuma, kuid langevad siis uuesti.
Siiriku ebaõnnestumine on tõsine, kuid see on harvaesinev pärast allogeensete tüvirakkude siirdamist, eriti kui doonor sobib hästi.
Meditsiinimeeskond jälgib tähelepanelikult verepilti ja kui uus tüvirakk hakkab ebaõnnestuma, võidakse patsienti esialgu ravida kasvufaktori hormoonidega. Need võivad julgustada luuüdi tüvirakke tootma rohkem rakke.
Kui doonori tüvirakud ei siirda, võib patsient vajada teist tüvirakkude siirdamist. See teine siirdamine võib pärineda kas samalt tüvirakkude doonorilt või erinevalt.
Hiline mõju
Hilised mõjud on terviseprobleemid, mis võivad tekkida kuid või aastaid pärast lümfoomiravi. Enamikul siirdamiskeskustel on spetsiaalsed hilise mõju teenused, mis pakuvad sõeluuringuprogramme, et tuvastada hilinenud mõjud võimalikult varakult. See annab patsiendile parima võimaluse saada edukat ravi, kui tal tekivad hilisemad kõrvaltoimed.
Patsientidel võib olla ka risk haigestuda siirdamisjärgsesse lümfoproliferatiivsesse häiresse (PTLD) – lümfoomidesse, mis võivad tekkida inimestel, kes võtavad pärast siirdamist immunosupressante. PTLD on aga haruldane. Enamikul siirdatud patsientidel ei teki PTLD-d.
Järelhooldus
Pärast tüvirakkude siirdamist toimuvad regulaarsed (iganädalased) kohtumised arstiga. Jälgimine jätkub kuude ja aastate jooksul pärast ravi, kuid aja möödudes harvemini. Lõpuks saavad siirdamisarstid anda järelravi üle patsientide perearstile.
Umbes 3 kuud pärast siirdamist, a PET-i skaneerimine, CT-skaneerimine ja / või luuüdi aspiraat (BMA) võib planeerida, et hinnata taastumise kulgu.
Tavaliselt tuleb siirdamisele järgnevatel nädalatel ja kuudel haiglasse ravile minna, kuid aja möödudes väheneb tõsiste tüsistuste risk.
Patsiendid kogevad tõenäoliselt ka suurte annustega ravi kõrvaltoimeid ning võivad tunda end halvasti ja väga väsinuna. Tüvirakkude siirdamisest taastumiseks kulub aga tavaliselt umbes aasta.
Meditsiinimeeskond peaks andma nõu muude tegurite kohta, mida taastumisperioodil arvestada. Lymphoma Australial on privaatne Facebooki veebileht Lymphoma Down Under, kus saate esitada küsimusi ja saada tuge teistelt lümfoomi või tüvirakkude siirdamisega inimestelt.
Mis juhtub pärast tüvirakkude siirdamist?
Viimistlusravi võib olla paljudele patsientidele keeruline aeg, kuna nad kohanevad pärast siirdamist uuesti eluga. Mõned ühised mured võivad olla seotud:
- füüsiline
- Vaimne heaolu
- Emotsionaalne tervis
- Suhted
- Töö, õppimine ja ühiskondlik tegevus
Lisainformatsioon
Steve'il diagnoositi mantelrakuline lümfoom aastal 2010. Steve on üle elanud nii autoloogse kui ka allogeense tüvirakkude siirdamise. See on Steve'i lugu.
Dr Nada Hamad, hematoloog ja luuüdi siirdamise arst
St Vincenti haigla, Sydney
Dr Amit Khot, hematoloog ja luuüdi siirdamise arst
Peter MacCallumi vähikeskus ja Melbourne'i kuninglik haigla
Dr Amit Khot, hematoloog ja luuüdi siirdamise arst
Peter MacCallumi vähikeskus ja Melbourne'i kuninglik haigla
Dr Amit Khot, hematoloog ja luuüdi siirdamise arst
Peter MacCallumi vähikeskus ja Melbourne'i kuninglik haigla
Dr Amit Khot, hematoloog ja luuüdi siirdamise arst
Peter MacCallumi vähikeskus ja Melbourne'i kuninglik haigla

